
本制品是一种通过探针法qPCR快速、有效、高灵敏地定量检测各种生物制品样品中E.coli宿主细胞残留基因组DNA含量的试剂盒。本制品为防污染型,含有优化比例的高品质UDG酶和dUTP,可有效消除PCR扩增过程中带来的产物污染问题造成的假阳性或CT值偏低。
本试剂盒提供了qPCR实验所需的预混液2×ByFast Probe qPCR Mix (含UDG)和特异性引物探针混合物。预混液包含了高质量、无E.coli DNA残留的ByFast Taq DNA Polymerase、UDG酶、PCR Buffer、dNTPs、dUTP、稳定剂和镁离子等所有的通用组分;高纯度引物探针混合物以E.coli 23S rDNA的保守区序列作为靶点所设计,二者结合可用于E.coli DNA的超高灵敏度定量检测。此外,本试剂盒提供E.coli DNA Control,作为阳性对照,用于检测试剂盒本身是否能正常工作及构建标准曲线。

大肠杆菌(E.coli)常用于大规模表达和生产目标蛋白或生物活性分子,包括重组蛋白、疫苗以及抗癌药物等新型医用生物制品。这些生物制品在生产过程中,会有少量大肠杆菌细胞DNA片段的残留。这些片段可能具有免疫原性、感染性或者致瘤性,当其残留水平过高时就可能引发免疫反应、致病性感染以及诱发肿瘤等安全问题。在许多国家和地区,药物注册和监管机构对生物制药产品中的宿主细胞DNA残留有严格的要求和限制。通过检测和控制宿主细胞DNA残留,可以评估生物制品的免疫原性风险和安全性。另外用于微量样品高通量测序时,也需要确保相关的大肠杆菌重组表达的酶没有大肠杆菌DNA的污染。

- 本试剂盒能高效灵敏地检测E.coli宿主细胞的残留DNA,最低检测限可至飞克。根据《中华人民共和国药典》2020年版第三部规定,检测DNA残留量的方法包括DNA探针杂交法、荧光染色法和定量PCR法,并且规定以细胞基质生产的生物制剂DNA残留量不能超过100pg/剂,以细菌或真菌基质生产的疫苗DNA残留量不能超过10ng/剂。本试剂盒基于中华人民共和国药典(2020年版)中外源性DNA残留量测定法中的定量PCR法,采用探针法qPCR,检测下限为3fg/μL,检测范围为3fg/μL~300pg/μL。
- 本试剂盒特异性强,HeLa细胞和CHO细胞基因组DNA对E.coli DNA残留检测无干扰。本试剂盒只检测E.coli宿主细胞DNA,与其它物种DNA无交叉反应。
- 本试剂盒稳定性高,不同程度的碎片化DNA对E.coli DNA残留检测基本无干扰。利用不同量微球菌核酸酶将E.coli DNA Control碎片化至不同程度,然后使用本试剂盒进行qPCR检测。结果显示,超过200bp的DNA,基本都会被检测到,不影响检测效果;但如果碎片化程度过于严重,导致200bp以下的DNA居多,会使DNA残留量检测值偏小。
- 本试剂盒重复性好。重复12次检测3pg/μL、30fg/μL E.coli DNA的CT值见下表,CV值(变异系数)均小于5%。
重复次数 1 2 3 4 5 6 7 8 9 10 11 12 CV 3pg/μL CT值 24.41 24.22 24.67 24.79 24.76 25.07 24.71 24.6 25.02 24.86 24.89 25.28 1.11% 30fg/μL CT值 31.54 31.48 30.79 32.2 31.73 30.71 31.99 31.49 31.48 32.1 31.53 31.73 1.38% - 本试剂盒可搭配宿主细胞残留DNA提取试剂盒(磁珠法)用于样品提取。使用E.coli DNA Control模拟样品的回收率测试结果见下表。
回收前残留DNA浓度 回收前体积 回收后残留DNA浓度 回收后体积 回收率 30fg/μL 100μL 32.55fg/μL 100μL 108.5% 3fg/μL 100μL 3.08fg/μL 100μL 102.7% - 回收率和样品浓度、体积、样品种类及实验操作等的不同而存在差异,表中数据仅供参考。
- 根据中华人民共和国药典(2020年版·三部)“外源性DNA残留测定法”中“第三法定量PCR”对于结果计算的要求,加标样品的回收率应在50%~150%之间。
- 回收率和样品浓度、体积、样品种类及实验操作等的不同而存在差异,表中数据仅供参考。

| 组分 | 50T | 200T |
| 2×ByFast Probe qPCR Mix(含UDG) | 500μL | 2mL |
| 10×Primer/Probe Mix | 100μL | 400μL |
| 超纯水 | 500μL | 2mL |
| Dilution Buffer | 3mL | 12mL |
| E.coli DNA Control(30ng/μL) | 50μL | 200μL |
| 50×Low ROX | 20μL | 80μL |
| 50×High ROX | 20μL | 80μL |
保存:-20℃,避免反复冻融,避光,有效期1年。

本试剂盒如果用于常规的96孔板qPCR检测(建议反应体系为20μL)或384孔板qPCR检测(建议反应体系为10μL),本制品小包装分别可以进行50次和100次检测,中包装分别可进行200次和400次检测。

本制品提供了Low ROX和High ROX,广泛兼容于无需ROX和需要Low ROX或High ROX作为校正染料的荧光定量PCR仪。ROX的作用是用于校正与PCR无关的荧光波动,从而最大限度减少孔间差异。这种差异可能由多种因素引起,如移液误差及样品蒸发等。不同的荧光定量PCR仪对ROX的要求不同,请根据实际所用仪器选择含高浓度ROX (High ROX)、低浓度ROX (Low ROX)或不含ROX的2×ByFast Probe qPCR Mix。通常含高浓度ROX的qPCR Mix也可以用于不需要ROX或需要低浓度ROX的荧光定量PCR仪。常用仪器所需ROX类型请参考如下表格。
| 添加ROX类型 | 适用PCR仪 |
| 不需添加 | Bio-Rad:CFX384,CFX96,MiniOpticon,iCycler IQ,MyiQ and iQ5; Eppendorf:Mastercycler ep realplex and realplex2 s; Qiagen/Corbett Rotor-Gene:6000; Roche LightCycler 480;Cepheid SmartCycler;Illumina Eco qPCR |
| Low ROX | ABI:7500(Fast),ViiA 7,QuantStudio 6 and 7 Flex Systems; Stratagene:Mx3000P,Mx3005P and Mx4000; Qiagen/Corbett Rotor-Gene:3000; Bio-Rad/MJ:Chromo4,Opticon 2 and Opticon |
| High ROX | ABI GeneAmp 5700;ABI PRISM 7000,7700;ABI 7300,7900HT(Fast);ABI StepOne (Plus) |

- 本制品请在首次开启后建议立即使用完毕,或务必在无菌条件下对其适当分装并保存于-20℃,以免空气中的大肠杆菌污染影响实验结果。
- 使用前请务必确保试剂完全融化,充分混匀后使用。混匀过程尽量避免产生气泡。
- 10×Primer/Probe Mix、50×Low ROX、50×High ROX中含有荧光染料,保存本制品或设置PCR反应体系时应避免强光照射,以尽量避免荧光淬灭问题。
- 经测试,本制品反复冻融10次对使用效果无显著影响,但仍需尽量避免反复冻融。反复冻融可能使产品性能下降。
- qPCR检测是超高灵敏度的检测,请尽量在标准的PCR实验室中进行检测。PCR反应设置区域须尽量避免各种可能的扩增产物的污染。虽然本制品为防污染型,但仍建议勿在PCR反应设置区域撕开PCR封板膜或打开PCR管盖,PCR产物宜密封后按扩增后产物要求处理,以避免超高浓度的PCR产物污染实验环境。
- 建议使用带滤芯的吸头配制PCR体系,这样可以最大限度的避免污染导致的假阳性。
- 建议使用低吸附的1.5mL离心管,样品回收率高。推荐无核酸酶离心管(1.5mL)。

- 用于阳性对照检测的平均CT值、平均lgCT以及根据标准曲线计算所得的浓度见下表,扩增及标准曲线参考图1。
Target 300pg/μL 30pg/μL 3pg/μL 300fg/μL 30fg/μL 3fg/μL NTC 平均CT值 18.99 21.95 25.28 29.08 31.9 35.2 Undetermined 平均lgCT 2.37 1.47 0.45 -0.71 -1.57 -2.57 - 浓度 236.5pg/μL 29.55pg/μL 2.85pg/μL 197.14fg/μL 27.18fg/μL 2.67fg/μL - 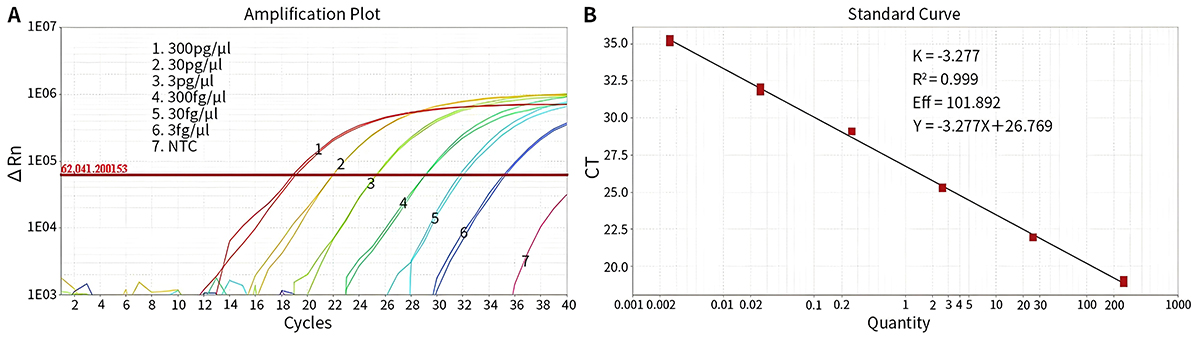
图1.本试剂盒用于不同浓度梯度的阳性对照的扩增曲线及标准曲线。将本试剂盒中的E.coli DNA Control稀释至浓度分别为300pg/μL、30pg/μL、3pg/μL、300fg/μL、30fg/μL和3fg/μL,然后用本试剂盒进行qPCR检测。NTC,No Template Control。实测数据可能会因样品、检测仪器等的不同而存在差异,图中数据仅供参考。 - 本试剂盒只检测E.coli宿主细胞DNA,与其它物种DNA无交叉反应。
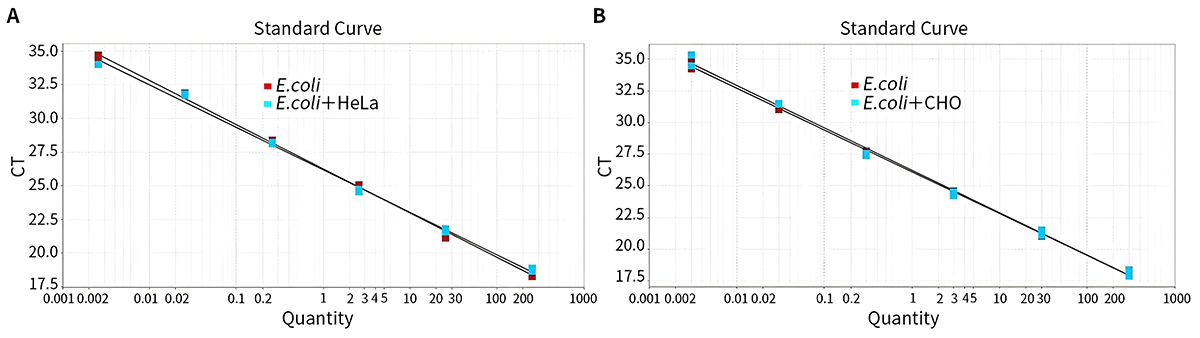
图2.本试剂盒检测不同浓度梯度阳性对照以及分别加入10倍量HeLa和CHO细胞基因组DNA的阳性对照的标准曲线。实测数据可能会因样品、检测仪器等的不同而存在差异,图中数据仅供参考。 - 本试剂盒检测不同碎片化程度DNA的扩增曲线及标准曲线参考图3,DNA碎片化处理的电泳结果参考图4。
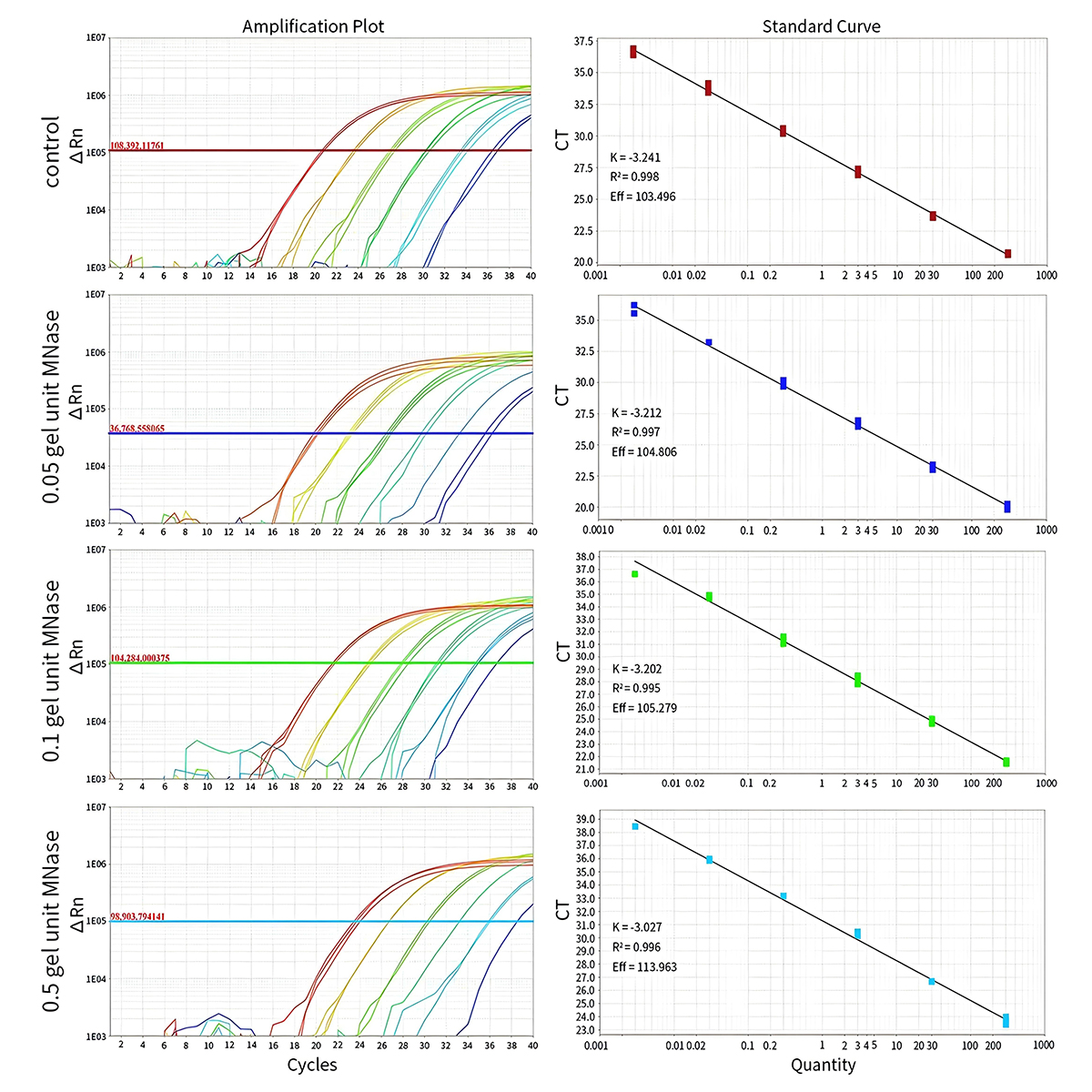
图3.本试剂盒对不同程度碎片化大肠杆菌DNA的检测效果图。E.coli基因组DNA经不同量MNase碎片化处理后稀释成如图1中的各个浓度进行检测。实验结果显示,在0.05和0.1 gel unit的MNase处理后,检测结果和未碎片化处理的对照(control)基本一致;在0.5 gel unit的MNase处理后,由于大部分DNA在200bp以下(见图4),此时CT值明显增加。实测数据可能会因样品、检测仪器等的不同而存在差异,图中数据仅供参考。
图4.不同量MNase碎片化处理的大肠杆菌基因组DNA的电泳图。E.coli DNA约0.5μg,37℃ 15分钟进行碎片化处理后终止反应。实测效果可能会因样品种类、检测仪器等的不同而存在差异,图中数据仅供参考。

- 需要用户自备的耗材、仪器和试剂:
- 具有FAM荧光通道的荧光定量PCR仪。
- DNase-free、RNase-free的吸头、低吸附离心管、荧光定量PCR用96孔板或384孔板、PCR板封板膜。
- 具有FAM荧光通道的荧光定量PCR仪。
- 样品准备:
选择合适的残留DNA样品制备试剂盒用于纯化提取生物制品的中间品、半成品和成品等中的大肠杆菌宿主细胞残留的基因组DNA,以此去除样品中抑制qPCR反应的物质。推荐使用磁珠法宿主细胞残留DNA提取试剂盒(货号:YTC0679)用于样品提取。- 由于本试剂盒灵敏度特别高,通常建议把样品制备的房间、qPCR反应体系配制的房间、处理扩增产物的房间按顺序分成3个房间,以避免出现假阳性。高浓度E.coli DNA Control处理时须特别小心,仅稀释后的E.coli DNA Control可以带入qPCR反应体系配制的房间。
- E.coli DNA Control标准曲线设置:
用本试剂盒中提供的Dilution Buffer将E.coli DNA Control (30ng/μL)进行梯度稀释,按照下表依次配制300pg/μL、30pg/μL、3pg/μL、300fg/μL、30fg/μL、3fg/μL的E.coli DNA Control。管号 稀释方法 浓度 ST0 10μL E.coli DNA Control (30ng/μL) + 90μL Dilution Buffer 3ng/μL ST1 10μL ST0 + 90μL Dilution Buffer 300pg/μL ST2 10μL ST1 + 90μL Dilution Buffer 30pg/μL ST3 10μL ST2 + 90μL Dilution Buffer 3pg/μL ST4 10μL ST3 + 90μL Dilution Buffer 300fg/μL ST5 10μL ST4 + 90μL Dilution Buffer 30fg/μL ST6 10μL ST5 + 90μL Dilution Buffer 3fg/μL - E.coli DNA Control (30ng/μL)和Dilution Buffer使用前置于冰上或4℃融化,Vortex充分混匀后使用。
- 每次稀释时应注意充分混匀。
- ST0管可置于-20℃保存,3个月有效;Dilution Buffer可置于4℃保存,至少一周有效,如果长时间不用,可以在-20℃保存。
- 样品加标回收质控ERC和阴性质控NEC的制备(选做):
根据实验需要,设置ERC (Extraction/Recovery Control),即在待测样品中加入已知浓度的标准品,与待测样品同时进行DNA提取,并进行qPCR检测,以计算待测样品的回收率,进而评估样品回收的效率。设置NEC (Negative Extraction Control),即仅含Dilution Buffer不含待测样品,与待测样品同时进行DNA提取,以评估检测系统本身、环境、人为等因素造成的误差及差异等。- ERC的制备:以制备加3pg E.coli DNA量的ERC为例,取90μL待测样品和10μL 300fg/μL (即3pg)的ST4加入1.5mL离心管中,充分混匀,标记为ERC。
- NEC的制备:取100μL Dilution Buffer加入1.5mL离心管中,标记为NEC。
- ERC、NEC与待测样品须同批进行提取处理(同步骤2)。若样品中E.coli DNA残留较高,需要稀释后再添加E.coli DNA标准品,加标量在样品量的0.1~10倍范围内比较合适。
- ERC的制备:以制备加3pg E.coli DNA量的ERC为例,取90μL待测样品和10μL 300fg/μL (即3pg)的ST4加入1.5mL离心管中,充分混匀,标记为ERC。
- qPCR反应体系的设置:
- 融解并混匀反应所需的各种溶液,置于冰浴上或冰盒内。
- 参考下表在室温或冰浴上设置qPCR反应体系(以96孔板,每孔反应体系为20μL为例)。下表中的Template为样品(纯化提取的或稀释后的)、无模板阴性对照(No Template Control,NTC)、标准品(E.coli DNA Control)、ERC或NEC (可选)。NTC可使用Dilution Buffer。建议每次检测都设置NTC和Standard。
成分 用量 2×ByFast Probe qPCR Mix(含UDG) 10μL 10×Primer/Probe Mix 2μL 模板 2μL 50×ROX 0或0.4μL 超纯水 至20μL - 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。
- 将设置好的PCR反应管或PCR反应板置于荧光定量PCR仪上,开始PCR反应。
- 荧光检测通道的选择:E.coli DNA Probe的荧光基团是FAM,可选择检测通道为FAM,淬灭基团是BHQ1,如果没有BHQ1,则选择无。
- 融解并混匀反应所需的各种溶液,置于冰浴上或冰盒内。
- qPCR反应程序:
本试剂盒建议采用如下的qPCR程序,本程序是以QuantStudio 6 Flex Systems荧光定量PCR仪为例:- UDG酶处理:50℃ 5min
- 预变性:95℃ 2min
- 变性:95℃ 15sec
- 退火/延伸:60℃ 30sec
- 重复步骤c和步骤d,总共40个循环
- 最后使用荧光定量PCR仪提供的软件分析检测结果
- UDG酶处理:50℃ 5min
- 结果的定性判断:
- 无模板阴性对照(NTC):FAM通道无典型扩增曲线,检测结果应为Undetermined或CT值≥38,或根据实验室自身验证结果设定具体标准;
- 标准曲线:R2≥0.98,扩增效率(Efficiency,Eff) = 90~110%;
- NEC的CT值大于标准曲线最低浓度的CT值;
- 样品浓度的计算:根据标准曲线有效范围内的CT值并结合标准曲线公式计算样品浓度(pg/μL或fg/μL)。请勿使用标准曲线有效范围之外的CT值计算待测样本的浓度;
- 加样回收率的计算:根据待测样品和加标样品(ERC)的检测结果计算加样回收率,加样回收率要求在50~150%之间。计算示例如步骤7f。
- 计算示例:
① 样品浓度计算示例:
使用磁珠法宿主细胞残留DNA提取试剂盒(货号:YTC0679)对100μL模拟待测样品(含BSA)以及对应的加标样品(即在待测样品基础上再添加一定量的标准品)进行制备操作,并使用本试剂盒检测样品浓度:复孔 待测样品CT值 待测样品lgCT 待测样品浓度 加标样品CT值 加标样品lgCT 加标样品浓度 1 33.53 0.97 9.36fg/μL 31.6 1.54 35.0fg/μL 2 34.30 0.74 5.53fg/μL 31.84 1.47 29.7fg/μL 3 33.82 0.89 7.68fg/μL 31.73 1.51 32.0fg/μL - 上表中用于计算样品浓度的标准曲线公式为:Y = -3.371X + 36.804,其中Y为CT值,X为该待测样品浓度的对数,斜率和Y轴截距是由荧光定量PCR仪自动生成。
根据步骤①中待测样品浓度及加标样品浓度,计算回收率:复孔 待测样品浓度 加标样品浓度 洗脱体积 加标量 回收率 1 9.36fg/μL 35.0fg/μL 100μL 3000fg 85.4% 2 5.53fg/μL 29.7fg/μL 100μL 3000fg 80.5% 3 7.68fg/μL 32.0fg/μL 100μL 3000fg 81.1% - 上表中用于计算加样回收率的公式为:(加标样品的浓度-待测样品的浓度)×洗脱体积/加标量。
- 无模板阴性对照(NTC):FAM通道无典型扩增曲线,检测结果应为Undetermined或CT值≥38,或根据实验室自身验证结果设定具体标准;
相关搜索:大肠杆菌DNA残留检测试剂盒,探针法qPCR,大肠杆菌DNA残留检测,E.coli基因组检测,大肠杆菌基因残留检测,大肠杆菌宿主DNA残留检测,大肠杆菌DNA检测,E.coli基因检测,大肠杆菌核酸检测,E.coli DNA Residue Probe qPCR Kit



